
วันนี้ (30 ก.ค.) จากการบรรยายพิเศษ Chula Pharma Talk เรื่อง “ประเด็นสำคัญในการเก็บและการเตรียมวัคซีนป้องกันโรคโควิด-19 ชนิด mRNA ของ Pfizer-BioNTech” ซึ่งคณะเภสัชศาสตร์ จุฬาฯ จัดขึ้นเมื่อวันที่ 27 กรกฎาคม 2564 ผศ.ภก.ดร.ปดินทร์ ติวสุวรรณ และ ผศ.ภญ.ดร.ณัฏฐดา อารีเปี่ยม คณะเภสัชศาสตร์ จุฬาฯ เปิดเผยว่า วัคซีนโควิดชนิด mRNA ของ Pfizer-BioNTech ที่สหรัฐอเมริกาจะบริจาคให้ประเทศไทย และจะส่งมอบสู่กลุ่มเป้าหมาย คือ บุคลากรการแพทย์ด่านหน้าเพื่อพร้อมฉีดในต้นเดือนสิงหาคมนี้ พร้อมกับเปิดเผยรายละเอียด เอกสารกำกับยาของวัคซีนไฟเซอร์ ที่จะมีการนำเข้ามาในประเทศไทยเร็วๆ นี้ โดยระบุว่าหากวัคซีนนำเข้ามาจากสหรัฐอเมริกาจะมีชื่อติดข้างขวดว่า Pfizer-BioNTech COVID-19 vaccine แต่เมื่อขายในแถบประเทศยุโรปและประเทศอื่นๆ จะมีใช้ชื่อการค้าว่า COMIRNATY และคาดว่าวัคซีนไฟเซอร์ที่ไทยจะนำเข้า 20 ล้านโดส อาจจะอยู่ภายใต้ชื่อ COMIRNATY
ส่วนรายละเอียดของเอกสารกำกับยา มีดังนี้
1. ชื่อผลิตภัณฑ์โคเมอร์เนตี(ComirnatyTM)
ชนิดเข้มข้นสำหรับกระจายตัวสำหรับฉีด (Concentrate for dispersion for injection)
วัคซีนเอ็มอาร์เอ็นเอ (mRNA Vaccine) สำหรับป้องกันโรคโควิด-19 (นิวคลีโอไซด์ที่ถูกดัดแปลง)
2. ปริมาณและคุณสมบัติของตัวยาสำคัญ
ใน 1 โดส (0.3 มิลลิลิตร) ประกอบด้วยตัวยาสำคัญ คือ วัคซีนเอ็มอาร์เอ็นเอโควิด-19 (ห่อหุ้มด้วยอนุภาคไขมัน
ขนาดนาโน) (COVID-19 mRNA Vaccine (embedded in lipid nanoparticles)) บรรจุอยู่ 30 ไมโครกรัม
ยานี้บรรจุในขวดแก้วสำหรับใช้หลายครั้ง (multi-dose vial) และจะต้องเจือจางก่อนใช้ใน 1 ขวด (0.45 มิลลิลิตร) บรรจุวัคซีนสำหรับฉีด 6 โดส โดสละ 0.3 มิลลิลิตรหลังเจือจางแล้ว ดูหัวข้อ 4.2.
ขนาดยาและวิธีการใช้ยา และ 6.6. ข้อควรระวังพิเศษในการกำจัดและการบริหารจัดการอื่นๆ-capped messenger RNA (mRNA) สายเดี่ยว (Single-stranded) ที่ผลิตขึ้นโดย cell-free transcription นอกร่างกาย (in vitro) จากแม่แบบดีเอ็นเอที่ตรงกัน (corresponding DNA templates) เข้ารหัสโปรตีนหนาม(viral spike [S]) ของไวรัส SARS-CoV-2
ส่วนประกอบอื่น ๆ โปรดดูหัวข้อ 6.1 รายการตัวยาไม่สำคัญ
3. ลักษณะและรูปแบบยาทางเภสัชกรรม
ยาชนิดเข้มข้นสำหรับกระจายตัวสำหรับฉีด (ยาเข้มข้นปราศจากเชื้อ)
วัคซีนแช่แข็งชนิดกระจายตัวที่มีสีขาวถึงสีออกเหลืองอ่อน (pH 6.9-7.9)
4. คุณสมบัติทางคลินิก
4.1. ข้อบ่งใช้
โคเมอร์เนตีมีข้อบ่งใช้สำหรับฉีดเพื่อกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันในผู้ที่มีอายุตั้งแต่ 12 ปีขึ้นไป เพื่อป้องกันโรคที่เกิดจากเชื้อไวรัสโคโรนา 2019 (โควิด-19)
4.2. ขนาดยาและวิธีการใช้ยา
ขนาดยา
บุคคลที่มีอายุ 12 ปีขึ้นไป
แผนการฉีดโคเมอร์เนตีประกอบด้วยการฉีดวัคซีนหลังเจือจางยาแล้วเข้าทางกล้ามเนื้อในขนาด 0.3 มิลลิลิตร
จำนวน 2 ครั้ง การฉีดกระตุ้นเข็มที่ 2 ควรให้หลังจากการฉีดเข็มแรก 3 สัปดาห์ (โปรดดูหัวข้อ 5.1. คุณสมบัติทางเภสัชพลศาสตร์)
แนะนำให้ผู้ที่ได้รับการฉีดโคเมอร์เนตีในเข็มแรก ควรได้รับการฉีดกระตุ้นในเข็มที่ 2 ด้วย โคเมอร์เนตี เช่นเดิม
(โปรดดูหัวข้อ 4.4 คำเตือนพิเศษและข้อควรระวังในการใช้ยา)
เด็ก
ยังไม่มีข้อมูลด้านประสิทธิผลและความปลอดภัยของโคเมอร์เนตีในเด็กที่อายุต่ำกว่า 12 ปี
ผู้สูงอายุ
ไม่จำเป็นต้องปรับขนาดยาในผู้สูงอายุที่มีอายุ 65 ปีขึ้นไป
วิธีการใช้ยา
ฉีดโคเมอร์เนตีเข้ากล้ามเนื้อเท่านั้น โดยเฉพาะกล้ามเนื้อเดลทอยด์ หลังเจือจางยาแล้ว (ดูหัวข้อ 6.6. ข้อควร
ระวังพิเศษในการกำจัดและการบริหารจัดการอื่นๆ)
ห้ามฉีดวัคซีนเข้าทางหลอดเลือดดำ ใต้ผิวหนัง หรือทางในผิวหนัง
หลังเจือจางแล้ว โคเมอร์เนตี 1 ขวดมีบรรจุวัคซีน 6 โดส โดสละ 0.3 มิลลิลิตร เพื่อให้ได้วัคซีน 6 โดสจาก 1 ขวดควรใช้กระบอกฉีดยาและ/หรือเข็มฉีดยาที่มีปริมาตรยาตกค้างต่ำ (low dead-volume) กระบอกฉีดยาและเข็มฉีดยาที่มีปริมาตรยาตกค้างต่ำควรมีปริมาตรยาตกค้างไม่มากกว่า 35 ไมโครลิตร หากใช้กระบอกฉีดยาและเข็มฉีดยาแบบมาตรฐาน วัคซีน 1 ขวดอาจมีปริมาตรไม่เพียงพอในการดูดวัคซีนสำหรับการฉีดโดสที่ 6
ในทุกการฉีด โดยไม่คำนึงถึงประเภทของกระบอกฉีดยาและเข็มฉีดยา มีข้อกำหนด ดังนี้
• ขนาดวัคซีนสำหรับฉีดแต่ละโดส ต้องมีปริมาตร 0.3 มิลลิลิตร
• หากปริมาณวัคซีนที่เหลืออยู่ในขวดวัคซีนไม่เพียงพอสำหรับการฉีดวัคซีนเต็มโดสที่ขนาด 0.3 มิลลิลิตร
ให้ทิ้งขวดวัคซีนและวัคซีนใดๆ ที่เหลือในขวด
• ห้ามนำวัคซีนจากหลายขวดวัคซีนมารวมกัน
ห้ามผสมวัคซีนนี้ในกระบอกฉีดยาเดียวกันกับวัคซีนหรือผลิตภัณฑ์ยาชนิดอื่น
สำหรับข้อควรระวังก่อนฉีดวัคซีน ดูหัวข้อ 4.4. คำเตือนพิเศษและข้อควรระวังในการใช้ยา
สำหรับคำแนะนำในการละลายวัคซีน วิธีการเจือจาง การจัดการ และการทิ้งวัคซีน ดูหัวข้อ 6.6. ข้อควรระวัง
พิเศษในการกำจัดและการบริหารจัดการอื่นๆ
4.3. ข้อห้ามใช้
ห้ามใช้โคเมอร์เนตีในผู้ที่แพ้ตัวยา หรือส่วนประกอบตัวใดตัวหนึ่งของวัคซีนนี้ (ดูหัวข้อ 2 ปริมาณและ
คุณสมบัติของตัวยาสำคัญ และ 6.1 รายการตัวยาไม่สำคัญ)
4.4. คำเตือนพิเศษและข้อควรระวังในการใช้ยา
การตรวจสอบย้อนกลับ
เพื่อการปรับปรุงการตรวจสอบย้อนกลับของผลิตภัณฑ์ยาชีววัตถุ ควรบันทึกชื่อและรุ่นการผลิตของวัคซีนที่ให้อย่างชัดเจน
ภาวะภูมิไวเกินและการแพ้
มีรายงานพบเหตุการณ์การแพ้แบบ anaphylaxis ควรมีการเตรียมความพร้อมตลอดเวลาสำหรับการดูแล และ
ให้การรักษาที่เหมาะสมในกรณีที่มีการแพ้ยาขั้นรุนแรง (anaphylactic reaction) หลังการฉีดวัคซีน
แนะนำให้มีการติดตามอาการอย่างใกล้ชิดอย่างน้อยที่สุด 30 นาทีหลังฉีดวัคซีน ไม่ควรฉีดวัคซีนครั้งที่ 2 ให้กับ
ผู้ที่เกิดการแพ้ยาขั้นรุนแรงจากการฉีดวัคซีนครั้งที่ 1
กล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบ
พบรายงานการเกิดภาวะกล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบหลังจากการฉีดโคเมอร์เนตีน้อยมาก รายงานส่วนใหญ่พบในเพศชายวัยหนุ่ม โดยจะเกิดอาการภายใน 14 วันหลังจากการฉีดวัคซีน โดยเฉพาะภายหลังการฉีดวัคซีนครั้งที่ 2 จากข้อมูลที่ปรากฏพบว่าการดำเนินโรคของภาวะกล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบภายหลังการได้รับวัคซีนไม่แตกต่างจากการดำเนินโรคของภาวะกล้ามเนื้อหัวใจอักเสบหรือเยื่อหุ้มหัวใจอักเสบในสภาวะปกติ
บุคลากรทางการแพทย์ควรระมัดระวังและสังเกตอาการและอาการแสดงของภาวะกล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบ ผู้ที่รับการฉีดวัคซีนควรได้รับคำอธิบายถึงวิธีการสังเกตอาการตนเองเพื่อสามารถแจ้งแพทย์ได้ทันท่วงทีหากมีอาการที่อาจบ่งชี้ถึงภาวะกล้ามเนื้อหัวใจอักเสบหรือเยื่อหุ้มหัวใจอักเสบ เช่น การเจ็บหน้าอก (แบบเฉียบพลันและอาการคงอยู่) หายใจสั้น หรือใจสั่นภายหลังจากการฉีดวัคซีน
บุคลากรทางการแพทย์ควรดำเนินการตามแนวทางปฏิบัติหรือปรึกษาแพทย์เฉพาะทางเพื่อวินิจฉัยและรักษาภาวะดังกล่าว
อาการที่เป็นผลจากความวิตกกังวล
อาการที่เป็นผลจากความวิตกกังวลรวมถึง ปฏิกิริยาของเส้นประสาทวากัส (หมดสติ) ภาวะหายใจถี่เร็วกว่าปกติ (hyperventilation) หรือปฏิกิริยาอันเนื่องมาจากความเครียด สามารถเกิดขึ้นร่วมกับการฉีดวัคซีน โดยเป็นการตอบสนองทางจิตใจต่อการฉีดยาด้วยเข็ม จึงเป็นสิ่งสำคัญที่จะต้องมีความระมัดระวังเพื่อหลีกเลี่ยงการบาดเจ็บจากการเป็นลม
ความเจ็บป่วยที่กำลังเป็นอยู่
เช่นเดียวกับวัคซีนชนิดอื่นๆ ควรเลื่อนการฉีดวัคซีนออกไปในผู้ที่มีอาการไข้สูงเฉียบพลันหรือการติดเชื้อเฉียบพลัน อย่างไรก็ตาม ไม่ควรเลื่อนการฉีดวัคซีนออกไป หากพบอาการของการติดเชื้อเพียงเล็กน้อย เช่น หวัด และ/หรือ มีไข้ต่ำ ๆ
ภาวะเกล็ดเลือดต่ำและความผิดปกติของการแข็งตัวของเลือด
เช่นเดียวกับยาฉีดเข้ากล้ามเนื้ออื่นๆ ควรฉีดวัคซีนด้วยความระมัดระวังในผู้ที่ได้รับยาต้านการแข็งตัวของเลือด หรือผู้ที่มีภาวะเกล็ดเลือดต่ำ หรือผู้ที่มีความผิดปกติเกี่ยวกับการแข็งตัวของเลือดใด (เช่น โรคฮีโมฟิเลีย) เนื่องจากอาจเกิดภาวะเลือดออกหรือจ้ำเลือดหลังจากการฉีดเข้ากล้ามเนื้อในบุคคลเหล่านี้
ผู้ที่มีภูมิคุ้มกันบกพร่อง
ยังไม่ได้ทำการประเมินประสิทธิผล ความปลอดภัย และความสามารถในการสร้างภูมิคุ้มกันของวัคซีนในผู้ที่มีภูมิคุ้มกันบกพร่อง รวมถึงผู้ที่ได้รับการรักษาด้วยยากดภูมิคุ้มกัน ประสิทธิผลของโคเมอร์เนตีอาจลดลงในผู้ที่มีภูมิคุ้มกันบกพร่อง
ระยะเวลาการป้องกันโรค
ยังไม่ทราบระยะเวลาในการป้องกันโรคของวัคซีนที่ชัดเจนเนื่องจากยังคงอยู่ระหว่างการวิจัย
การเปลี่ยนยา
ไม่มีข้อมูลเกี่ยวกับการใช้วัคซีนป้องกันโรคโควิด-19 อื่นๆ แทนโคเมอร์เนตีเพื่อฉีดวัคซีนให้ครบ ผู้ที่ได้รับวัคซีนโคเมอร์เนตีแล้ว 1 เข็ม ควรได้รับวัคซีนโคเมอร์เนตีเข็มที่ 2 เพื่อให้ครบคอร์สการให้วัคซีน
ข้อจำกัดของประสิทธิผลของวัคซีน
เช่นเดียวกับวัคซีนอื่น การฉีดวัคซีนโคเมอร์เนตีอาจไม่ได้ป้องกันโรคในผู้รับวัคซีนทุกราย ผู้ที่ฉีดวัคซีนอาจไม่ได้รับการป้องกันอย่างเต็มที่จนกว่าจะได้รับวัคซีนโดสที่สองไปแล้ว 7 วัน
โพแทสเซียม
ผลิตภัณฑ์นี้มีโพแทสเซียมเป็นส่วนประกอบน้อยกว่า 1 มิลลิโมล (39 มิลลิกรัม) ต่อโดส และได้รับการพิจารณาว่าเป็นผลิตภัณฑ์ที่ปราศจากโพแทสเซียม
โซเดียม
ผลิตภัณฑ์นี้มีโซเดียมเป็นส่วนประกอบน้อยกว่า 1 มิลลิโมล (23 มิลลิกรัม) ต่อโดส และได้รับการพิจารณาว่าเป็นผลิตภัณฑ์ที่ปราศจากโซเดียม
4.5. อันตรกิริยากับยาอื่นๆ และอันตรกิริยาอื่นๆ
ยังไม่มีการศึกษาอันตรกิริยา
ยังไม่มีการศึกษาการฉีดวัคซีนโคเมอร์เนตีร่วมกับวัคซีนอื่น
4.6. การเจริญพันธุ์การใช้ในสตรีมีครรภ์และสตรีระหว่างให้นมบุตร สตรีมีครรภ์
ยังมีประสบการณ์ที่จำกัดสำหรับการใช้โคเมอร์เนตีในสตรีมีครรภ์ การศึกษาในสัตว์ไม่ได้บ่งชี้ถึงผลที่เป็นอันตรายทางตรงหรือทางอ้อมในส่วนที่เกี่ยวข้องกับการตั้งครรภ์ พัฒนาการของเอ็มบริโอ/ตัวอ่อนในครรภ์ การคลอดลูก หรือพัฒนาการหลังคลอด (ดูหัวข้อ 5.3. ข้อมูลความ
ปลอดภัยจากการศึกษา พรีคลินิก)ควรพิจารณาโคเมอร์เนตีในสตรีมีครรภ์เมื่อประโยชน์ที่จะได้รับมากกว่าความเสี่ยงที่อาจเกิดขึ้นต่อแม่และ
ทารกในครรภ์
ระหว่างให้นมบุตร
ยังไม่ทราบแน่ชัดว่าโคเมอร์เนตีถูกขับออกทางน้ำนมหรือไม่
ควรพิจารณาให้โคเมอร์เนตีในสตรีระหว่างให้นมบุตร เมื่อประโยชน์ที่จะได้รับมากกว่าความเสี่ยงที่อาจเกิดขึ้นต่อแม่และเด็กทารก
การเจริญพันธุ์
การศึกษาในสัตว์ทดลองยังไม่สามารถบ่งชี้ถึงผลกระทบทั้งในทางตรงหรือทางอ้อมว่ามีอันตรายต่อระบบ
สืบพันธุ์หรือไม่ (โปรดดูหัวข้อ 5.3 ข้อมูลความปลอดภัยจากการศึกษาพรีคลินิก)
4.7. ผลต่อความสามารถในการขับขี่และทำงานกับเครื่องจักรกล
โคเมอร์เนตีไม่มีผลหรือมีผลต่อความสามารถในการขับขี่ยานพาหนะและการทำงานเกี่ยวกับเครื่องจักรกลน้อย แต่อย่างไรก็ตามอาการไม่พึงประสงค์บางอย่างที่มีระบุในหัวข้อ 4.8 อาการไม่พึงประสงค์ อาจส่งผลกระทบชั่วคราวต่อความสามารถในการขับขี่ยานพาหนะและการทำงานเกี่ยวกับเครื่องจักรกล
4.8. อาการไม่พึงประสงค์
บทสรุปข้อมูลด้านความปลอดภัย
ความปลอดภัยของโคเมอร์เนตีได้รับการประเมินในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่ 12 ปีขึ้นไป จากการศึกษาทางคลินิก 2 การศึกษา จำนวน 22,875 ราย (ประกอบด้วย ผู้มีอายุ 16 ปีขึ้นไป จำนวน 21,744 ราย และผู้มีอายุ 12 ถึง 15 ปีจำนวน 1,131 ราย) โดยเป็นผู้ได้รับวัคซีนโคเมอร์เนตีอย่างน้อยหนึ่งเข็มข้อมูลความปลอดภัยโดยรวมของโคเมอร์เนตีในวัยรุ่นที่มีอายุ 12 ถึง 15 ปี คล้ายกับที่พบในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่ 16 ปีขึ้นไป
ผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่16 ปีขึ้นไป
ในการศึกษาที่ 2 มีลักษณะของผู้เข้าร่วมการศึกษาดังนี้ ผู้เข้าร่วมการศึกษา จำนวน 21,720 ราย เป็นผู้ที่มีอายุ 16 ปีขึ้นไปและได้รับโคเมอร์เนตีอย่างน้อย 1 เข็ม ส่วนผู้เข้าร่วมการศึกษา จำนวน 21,728 รายเป็นผู้ที่มีอายุตั้งแต่16 ปีขึ้นไป ที่ได้รับยาหลอก(โดยมี138 ราย และ 145 ราย เป็นผู้ที่มีอายุ 16 และ 17 ปีในกลุ่มที่รับวัคซีนและยาหลอก ตามลำดับ) ทั้งนี้ มีผู้เข้าร่วมการศึกษา จำนวน 20,519 ราย เป็นผู้ที่มีอายุ 16 ปีขึ้นไปที่ได้รับโคเมอร์เนตีครบ 2 เข็ม
ณ เวลาที่ทำการวิเคราะห์ข้อมูลของการศึกษาที่ 2 ได้มีการประเมินความปลอดภัยในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่16 ปีขึ้นไปทั้งสิ้น 19,067 ราย (โดยเป็นผู้ที่ได้รับโคเมอร์เนตี 9,531 ราย และผู้ที่ได้รับยาหลอก9,536 ราย) เป็นเวลาอย่างน้อย 2 เดือนหลังจากที่ได้รับโคเมอร์เนตี/ยาหลอก เข็มที่ 2 โดยในจำนวนนี้ แบ่งเป็นผู้ที่มีอายุ 16 ถึง 55 ปี10,727 ราย (เป็นผู้ได้รับโคเมอร์เนตี 5,350 ราย และยาหลอก 5,377 ราย) และผู้ที่มีอายุตั้งแต่ 56 ปีขึ้นไป 8,340 ราย (เป็นผู้ได้รับโคเมอร์เนตี 4,181 ราย และยาหลอก 4,159 ราย)
อาการไม่พึงประสงค์ที่พบบ่อยที่สุดในผู้ที่มีอายุตั้งแต่ 16 ปีขึ้นไป คือ อาการปวดบริเวณที่ฉีด (มากกว่าร้อยละ 80) อ่อนล้า (มากกว่าร้อยละ 60) ปวดศีรษะ (มากกว่าร้อยละ 50) ปวดกล้ามเนื้อและหนาวสั่น (มากกว่าร้อยละ30) ปวดข้อ (มากกว่าร้อยละ 20) ไข้และบวมบริเวณที่ฉีด (มากกว่าร้อยละ 10) โดยมักมีความรุนแรงต่ำหรือปานกลาง และหายเป็นปกติภายในไม่กี่วันหลังจากฉีดวัคซีน พบว่าการเกิดเหตุการณ์ของการก่อปฏิกิริยา(reactogenicity) มีความถี่ต่ำลงเล็กน้อยโดยมีความสัมพันธ์กับอายุที่มากขึ้น
ข้อมูลความปลอดภัยในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่ 16 ปีขึ้นไปจำนวน 545 รายที่ได้รับโคเมอร์เนตี ซึ่งมีผลการตรวจ SARS-CoV-2 ในเลือดเป็นบวกที่จุดเริ่มต้นการศึกษามีความใกล้เคียงกับที่ได้พบในกลุ่มประชากรทั่วไป
ผู้ที่มีอายุ12 ถึง 15 ปี
ในการวิเคราะห์ข้อมูลของการศึกษาที่ 2 จากข้อมูลจนถึงวันที่ตัดข้อมูลในวันที่ 13 มีนาคม 2564 มีผู้ที่มีอายุ 12 ถึง 15 ปี จำนวน 2,260 ราย (ได้รับโคเมอร์เนตี 1,131 ราย และ ได้รับยาหลอก 1,129 ราย) โดยในจำนวนนี้มีผู้ถูกติดตามอาการเป็นเวลาอย่างน้อยที่สุด 2 เดือนหลังจากที่ได้รับวัคซีนโคเมอร์เนตีเข็มที่ 2 จำนวน 1,308 ราย (660 รายได้รับโคเมอร์เนตีและ 648 รายได้รับยาหลอก) ทั้งนี้การประเมินความปลอดภัยในการศึกษาที่ 2 ยังไม่สิ้นสุดการศึกษา
อาการไม่พึงประสงค์ที่พบบ่อยที่สุดในผู้ที่มีอายุ 12 ถึง 15 ปีคือ อาการปวดบริเวณที่ฉีดยา (มากกว่าร้อยละ 90) อ่อนล้าและปวดศีรษะ (มากกว่าร้อยละ 70) ปวดกล้ามเนื้อและหนาวสั่น (มากกว่าร้อยละ 40) ปวดข้อและมีไข้ (มากกว่าร้อยละ 20)

ตารางแสดงอาการไม่พึงประสงค์จากการศึกษาทางคลินิกและการใช้วัคซีนภายหลังการอนุมัติในผู้ที่มีอายุ
ตั้งแต่ 12 ปีขึ้นไป
อาการไม่พึงประสงค์ที่พบในระหว่างการศึกษาทางคลินิกได้แสดงไว้ด้านล่างตามหมวดความถี่ต่อไปนี้
พบบ่อยมาก (มากกว่าหรือเท่ากับ 1/10)
พบบ่อย (มากกว่าหรือเท่ากับ 1/100 ถึงน้อยกว่า 1/10)
พบไม่บ่อย (มากกว่าหรือเท่ากับ 1/1,000 ถึงน้อยกว่า 1/100)
พบน้อย (มากกว่าหรือเท่ากับ 1/10,000 ถึงน้อยกว่า 1/1,000)
พบน้อยมาก (น้อยกว่า 1/10,000)
ไม่ทราบความถี่ (ไม่สามารถประเมินได้จากข้อมูลที่มีอยู่)
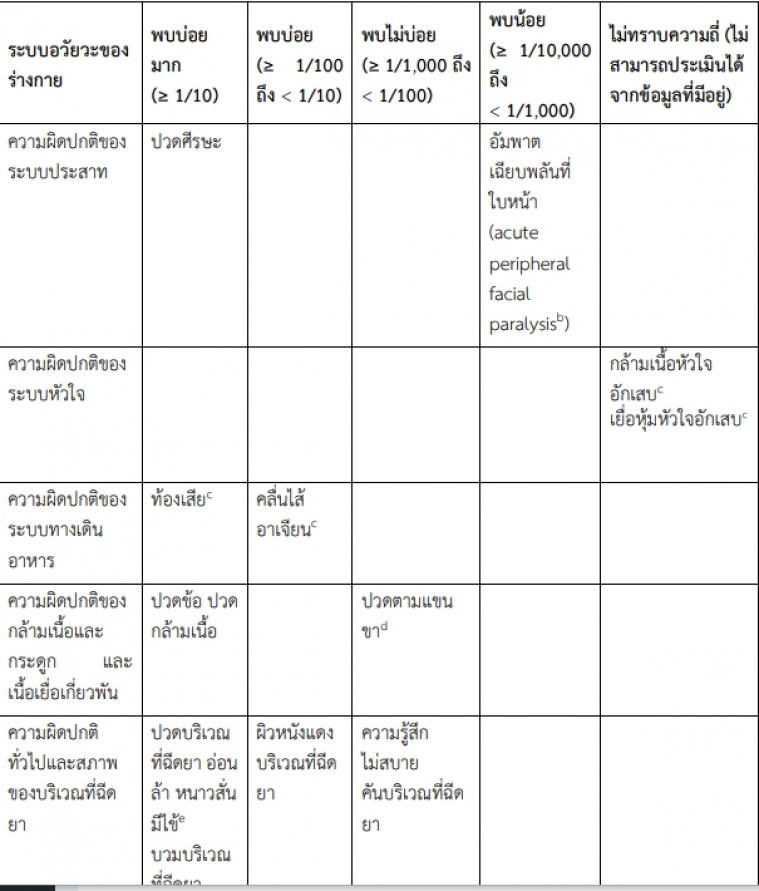
a. หมวดความถี่สำหรับลมพิษ และ angioedema คือ พบน้อย
b. จากระยะติดตามผลด้านความปลอดภัยของการศึกษาทางคลินิกไปจนถึงวันที่ 14 พฤศจิกายน 2563 มีรายงานพบ
อัมพาตเฉียบพลันที่ใบหน้า (หรือใบหน้าอัมพาตครึ่งซีก) ในผู้เข้าร่วมการศึกษาสี่รายในกลุ่มที่ได้รับวัคซีนเอ็มอาร์เอ็นเอ
สำหรับป้องกันโรคโควิด-19 วันที่เริ่มมีอาการอัมพาตที่ใบหน้าคือ วันที่ 37 หลังการฉีดวัคซีนครั้งที่ 1 (ผู้เข้าร่วม
การศึกษาไม่ได้รับการฉีดวัคซีนครั้งที่ 2) และวันที่ 3, 9 และ 48 หลังการฉีดวัคซีนครั้งที่ 2 ไม่มีรายงานพบการเกิด
อัมพาตเฉียบพลันที่ใบหน้า (หรือใบหน้าอัมพาตครึ่งซีก) ในกลุ่มยาหลอก
c. อาการไม่พึงประสงค์ที่ระบุพบหลังภายหลังจากอนุญาตให้ใช้
d. อ้างถึงแขนข้างที่ฉีดวัคซีน
e. ได้สังเกตพบการเกิดอาการไข้ในความถี่ที่สูงกว่าหลังการฉีดวัคซีนครั้งที่สอง
9
การรายงานเหตุการณ์ที่สงสัยว่าจะเป็นอาการไม่พึงประสงค์
การรายงานอาการไม่พึงประสงค์ที่สงสัยหลังจากได้รับอนุญาตของผลิตภัณฑ์ยาเป็นสิ่งสําคัญ ช่วยให้สามารถตรวจสอบความสมดุลของประโยชน์/ความเสี่ยงของผลิตภัณฑ์ยาอย่างต่อเนื่อง
4.9. การได้รับยาเกินขนาด
ข้อมูลการได้รับยาเกินขนาดได้มาจากผู้เข้าร่วมการศึกษา 52 ราย ที่รวมอยู่ในการศึกษาทางคลินิกซึ่งได้รับโคเมอร์เนตี 58 ไมโครกรัม เนื่องมาจากความผิดพลาดในการเจือจาง ผู้รับวัคซีนไม่ได้รายงานถึงการเพิ่มขึ้นของการก่อปฏิกิริยา (reactogenicity) หรืออาการไม่พึงประสงค์
ในกรณีของการได้รับยาเกินขนาด แนะนำให้ตรวจติดตามการทำงานของอวัยวะสำคัญในการคงชีพและอาจให้การรักษาตามอาการ
5. คุณสมบัติทางเภสัชวิทยา
5.1. คุณสมบัติทางเภสัชพลศาสตร์
กลุ่มการรักษาทางเภสัชวิทยา: วัคซีน วัคซีนไวรัสอื่นๆ รหัส ATC: J07BX03
กลไกการออกฤทธิ์
Messenger RNA ที่ถูกดัดแปลงนิวคลีโอไซด์ในวัคซีนโคเมอร์เนตีถูกสร้างขึ้นในอนุภาคไขมันขนาดนาโน ซึ่งทำให้สามารถส่ง non-replicating RNA เข้าไปในเซลล์โฮสต์เพื่อให้สามารถมีการแสดงออกของ S แอนติเจนของ SARS-CoV-2 โดยตรงอย่างชั่วคราวได้ mRNA นี้มีรหัสสำหรับ membrane-anchored, full-length S ที่มีการกลายพันธุ์สองตำแหน่งภายในสายเกลียวกลาง (central helix) การกลายพันธุ์ของกรดอะมิโนสองตัวนี้ไปเป็นโพรลีน (proline) จะบังคับให้ S อยู่ในโครงสร้างแบบ prefusion conformation ซึ่งเป็นโครงสร้างที่เป็นที่ต้องการมากกว่าในแง่ของการเป็นแอนติเจน วัคซีนกระตุ้นให้เกิดทั้งแอนติบอดีที่ยับยั้งการติดเชื้อ (neutralizing antibody) และการตอบสนองทางภูมิคุ้มกันของเซลล์ต่อแอนติเจนของหนาม (S) ซึ่งอาจมีส่วนช่วยในการป้องกันจากการติดเชื้อโรคโควิด-19
ประสิทธิผลทางคลินิก
การศึกษาที่ 2 เป็นการศึกษาทางคลินิก ระยะที่ 1/2/3 แบบสุ่ม มีกลุ่มควบคุมเป็นยาหลอก ปกปิดข้อมูลผู้สังเกตการณ์ที่ดำเนินการในหลายศูนย์ หลายประเทศ เพื่อหาขนาดยาที่เหมาะสม คัดเลือกผู้รับวัคซีน และประเมินประสิทธิผลในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่ 12 ปีขึ้นไป การสุ่มได้รับการแบ่งชั้นตามอายุดังนี้อายุ 12 ถึง 15 ปี อายุ 16 ถึง 55 ปี หรืออายุ 56 ปีขึ้นไป โดยมีผู้เข้าร่วมการศึกษาอย่างน้อยร้อยละ 40 อยู่ในกลุ่มอายุมากกว่าหรือเท่ากับ 56 ปี การศึกษานี้คัดผู้เข้าร่วมการศึกษาที่มีภูมิคุ้มกันบกพร่องและเป็นผู้ที่ได้รับการวินิจฉัยทางคลินิกหรือทางจุลชีววิทยาว่าเป็นโรคโควิด-19 มาก่อน ออกจากการศึกษา สำหรับผู้ที่มีโรคประจำตัวที่เป็นมาก่อนหน้าแต่มีอาการคงที่ (ตามนิยาม คือ ไม่มีการเปลี่ยนแปลงอย่างมีนัยสำคัญด้านการรักษา หรือเข้าพักรักษาตัวในโรงพยาบาลจากการแย่ลงของโรค ตลอดช่วงระยะเวลา 6 สัปดาห์ก่อนการเข้าร่วมการศึกษา) ได้ถูกคัดเลือกเข้าร่วมการศึกษาเช่นเดียวกับผู้ที่ติดเชื้อไวรัสภูมิคุ้มกันบกพร่องในคน (human immunodeficiency virus [HIV]) ไวรัสตับอักเสบซี (hepatitis C [HCV]) หรือไวรัสตับอักเสบบี (hepatitis B virus [HBV]) ที่มีอาการคงที่
ประสิทธิผลของวัคซีนในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่16 ปีขึ้นไป
ในส่วนของระยะที่ 2/3 ของการศึกษาที่ 2 จากข้อมูลที่เก็บสะสมจนถึงวันที่ 14 พฤศจิกายน 2563 ผู้เข้าร่วมการศึกษาประมาณ 44,000 ราย ถูกสุ่มอย่างเท่าเทียมกันและได้รับวัคซีนชนิดเอ็มอาร์เอ็นเอเพื่อป้องกันโรควิด-19 หรือยาหลอก 2 เข็ม โดยฉีดวัคซีนแต่ละเข็มห่างกัน 21 วัน การวิเคราะห์ประสิทธิผลได้รวมผู้ที่ได้รับวัคซีนเข็มที่2 ภายใน 19 ถึง 42 วันหลังจากที่ฉีดวัคซีนเข็มแรก ผู้รับวัคซีนส่วนใหญ่ (ร้อยละ 93.1) ได้รับวัคซีนเข็มที่ 2 ภายใน 19 วันถึง 23 วันหลังจากที่ฉีดวัคซีนเข็มแรก ทั้งนี้ผู้เข้าร่วมการศึกษาจะถูกติดตามผลนาน 24 เดือนหลังจากที่ได้รับวัคซีนเข็มที่ 2 เพื่อประเมินความปลอดภัยและประสิทธิผลต่อโรคโควิด-19 ในการศึกษาทางคลินิกนี้ผู้เข้าร่วมการศึกษาจำเป็นต้องเว้นระยะเวลาอย่างน้อย 14 วันก่อนและหลังการฉีดวัคซีนไข้หวัดใหญ่เพื่อที่จะได้รับยาหลอกหรือวัคซีนชนิดเอ็มอาร์เอ็นเอเพื่อป้องกันโรคโควิด-19 รวมทั้งจำเป็นต้องเว้นระยะเวลาอย่างน้อย 60 วันก่อนและหลังการรับผลิตภัณฑ์ที่ผลิตมาจากเลือด/พลาสมา หรืออิมมูโนโกลบูลินไปจนเสร็จสิ้นการสรุปข้อมูลการศึกษาเพื่อที่จะได้รับยาหลอกหรือวัคซีนชนิดเอ็มอาร์เอ็นเอเพื่อป้องกันโรคโควิด-19
ในการวิเคราะห์จุดยุติหลักทางด้านประสิทธิผลได้รวมผู้เข้าร่วมการศึกษา 36,621 รายที่มีอายุตั้งแต่ 12 ปีขึ้นไป (18,242 รายในกลุ่มที่รับวัคซีนเอ็มอาร์เอ็นเอสำหรับป้องกันโรคโควิด-19 และ 18,379 รายในกลุ่มที่ได้รับยาหลอก) โดยเป็นผู้ไม่มีหลักฐานของการติดเชื้อ SARS-CoV-2 มาก่อนจนถึง 7 วันหลังจากที่รับวัคซีนเข็มที่ 2
ทั้งนี้ ผู้เข้าร่วมการศึกษา 134 รายเป็นผู้ที่มีอายุระหว่าง 16 ถึง 17 ปี (66 รายในกลุ่มที่รับวัคซีนเอ็มอาร์เอ็นเอสำหรับป้องกันโรคโควิด-19 และ 68 รายในกลุ่มที่รับยาหลอก) และผู้เข้าร่วมการศึกษา 1,616 รายเป็นผู้ที่มีอายุ 75 ปีขึ้นไป (804 รายในกลุ่มที่รับวัคซีนเอ็มอาร์เอ็นเอสำหรับป้องกันโรคโควิด-19 และ 812 รายในกลุ่มที่รับยาหลอก)
ณ เวลาที่ทำการวิเคราะห์ประสิทธิผลหลัก ได้ทำการติดตามอาการของโรคโควิด-19 ที่แสดงอาการในผู้เข้าร่วมการศึกษาทั้งสิ้น 2,214 person-years สำหรับกลุ่มที่รับวัคซีนเอ็มอาร์เอ็นเอสำหรับป้องกันโรคโควิด-19 และทั้งสิ้น 2,222 person-years ในกลุ่มที่รับยาหลอก
ไม่มีความแตกต่างที่มีความหมายทางคลินิกในประสิทธิผลโดยรวมของวัคซีนในผู้เข้าร่วมการศึกษาที่มีความเสี่ยงต่อการเกิดโรคโควิด-19 ที่มีอาการรุนแรง รวมถึงผู้ที่มีโรคที่เกิดร่วมกัน 1 โรคขึ้นไป ซึ่งเพิ่มความเสี่ยงต่อการเกิดโรคโควิด-19 ที่มีอาการรุนแรง (ตัวอย่างเช่น โรคหืด มีดัชนีมวลกาย (body mass index [BMI]) มากกว่าหรือเท่ากับ 30 กิโลกรัม/ตารางเมตร โรคปอดเรื้อรัง เบาหวาน ความดันโลหิตสูง)ข้อมูลประสิทธิผลของวัคซีนแสดงไว้ใน ตารางที่ 2
ตารางที่ 2 : ประสิทธิผลของวัคซีน-การเกิดโรคโควิด-19 ครั้งแรกจาก 7 วันหลังจากได้รับวัคซีนเข็มที่ 2 โดยเรียงตามกลุ่มย่อยของอายุ-ผู้เข้าร่วมการศึกษาที่ไม่มีหลักฐานของการติดเชื้อก่อน 7 วัน หลังจากที่ได้รับวัคซีนเข็มที่ 2-ประชากรที่สามารถประเมินประสิทธิผลได้ (7 วัน)

หมายเหตุ : รายงานผู้ป่วยที่ได้รับการยืนยันถูกกำหนดตามปฏิกิริยาลูกโซ่พอลิเมอเรสแบบย้อนกลับ (Reverse TranscriptionPolymerase Chain Reaction [RT-PCR]) และมีอาการอย่างน้อยที่สุด 1 อาการที่สอดคล้องกับอาการของโควิด-19 [*คำจำกัด ความของรายงานผู้ป่วย: (มีอาการอย่างน้อยที่สุด 1 อาการของ) มีไข้ ไอที่เกิดขึ้นใหม่หรือไอเพิ่มขึ้น หายใจลำบากที่เกิดขึ้นใหม่ หรือมีอาการเพิ่มขึ้น หนาวสั่น ปวดกล้ามเนื้อที่เกิดขึ้นใหม่หรือมีอาการเพิ่มขึ้น สูญเสียการรับรสหรือรับกลิ่นที่เกิดขึ้นใหม่ เจ็บคอ ท้องเสีย หรืออาเจียน] * ผู้เข้าร่วมการศึกษาที่ไม่มีหลักฐานทางภูมิคุ้มกันวิทยาหรือทางไวรัสวิทยา (ก่อน 7 วันหลังจากที่ได้รับวัคซีนครั้งสุดท้าย) ของ การติดเชื้อ SARS-CoV-2 ในอดีต (นั่นคือ มีผลการตรวจ N-binding antibody [ซีรัม] เป็นลบที่การนัดตรวจครั้งที่ 1 และ ตรวจไม่พบ SARS-CoV-2 โดยการตรวจ nucleic acid amplification tests (NAAT) [การป้ายโพรงจมูก] ที่การนัดตรวจ ครั้งที่ 1 และ 2) และมีผลการตรวจ NAAT (การป้ายโพรงจมูก) เป็นลบที่การนัดตรวจที่ไม่ได้กำหนดไว้ล่วงหน้าก่อน 7 วัน หลังจากที่ได้รับวัคซีนครั้งที่ 2 ถูกรวมเข้าไปในการวิเคราะห์ข้อมูล a. N = จำนวนผู้เข้าร่วมการศึกษาวิจัยในกลุ่มที่ระบุ b. n1 = จำนวนผู้เข้าร่วมการศึกษาวิจัยที่ตรงตามนิยามจุดยุติ c. ระยะเวลาในการเฝ้าระวังทั้งหมดในหน่วย 1,000 person-years สำหรับจุดยุติที่กำหนดของผู้เข้าร่วมการศึกษาทั้งหมดใน แต่ละกลุ่มที่มีความเสี่ยงต่อจุดยุติ ระยะเวลาของการรับรายงานผู้ป่วยโรคโควิด-19 คือ จาก 7 วันหลังจากที่ได้รับวัคซีนเข็มที่ 2 ถึงจุดสิ้นสุดระยะเวลาเฝ้าระวัง d. n2 = จำนวนผู้เข้าร่วมการศึกษาที่มีความเสี่ยงต่อจุดยุต
e. ช่วงความเชื่อมั่น (confidence interval [CI]) สำหรับประสิทธิผลของวัคซีนได้มาจากวิธี Clopperและ Pearson ที่ได้รับ การปรับให้เข้ากับระยะเวลาในการเฝ้าระวัง ไม่ได้ปรับ CI สำหรับความหลากหลาย ประสิทธิผลของวัคซีนเอ็มอาร์เอ็นเอสำหรับป้องกันโรคโควิด-19 ในการป้องกันการเกิดโรคโควิด-19 ครั้งแรก จาก 7 วันหลังจากที่ได้รับวัคซีนเข็มที่ 2 เมื่อเทียบกับยาหลอกอยู่ที่ร้อยละ 94.6 (ช่วงความเชื่อมั่น 95%เท่ากับ ร้อยละ 89.6 ถึงร้อยละ 97.6) ในผู้เข้าร่วมการศึกษาที่มีอายุตั้งแต่ 16 ปีขึ้นไปที่มีหรือไม่มีหลักฐานของการ ติดเชื้อ SARS-CoV-2 มาก่อน นอกจากนี้ การวิเคราะห์กลุ่มย่อยของจุดยุติหลักทางด้านประสิทธิผลได้แสดงให้เห็นถึงค่าประมาณการจุดยุติ ทางด้านประสิทธิผลที่คล้ายคลึงกันทั่วทั้งกลุ่มที่แบ่งตามเพศ เชื้อชาติ และผู้เข้าร่วมการศึกษาที่มีโรคร่วมที่มี ความเสี่ยงสูงต่อการเกิดโรคโควิด-19 ที่มีอาการรุนแรง
ประสิทธิผลและความสามารถในการสร้างภูมิคุ้มกันในวัยรุ่นที่มีอายุ12 ถึง 15 ปี ในการวิเคราะห์ข้อมูลของการศึกษาที่ 2 ในผู้ที่มีอายุ 12 ถึง 15 ปีซึ่งไม่มีหลักฐานว่าเคยติดเชื้อมาก่อน ไม่มี รายงานการติดเชื้อในผู้เข้าร่วมการศึกษา 1,005 รายที่ได้รับวัคซีน และมีรายงานการติดเชื้อ 16 รายจาก ผู้เข้าร่วมการศึกษา 978 รายที่ได้รับยาหลอก ค่าประมาณการจุดยุติด้านประสิทธิผล เป็นร้อยละ 100 (ช่วง ความเชื่อมั่น 95% อยู่ที่ 75.3 และ 100.0) สำหรับในผู้เข้าร่วมการศึกษาทั้งที่มีและไม่มีหลักฐานของการติดเชื้อ มาก่อน มีรายงานการติดเชื้อเป็น 0 รายจากผู้เข้าร่วมการศึกษา 1,119 รายที่ได้รับวัคซีน และมีรายงานการติด เชื้อ 18 รายจากผู้เข้าร่วมการศึกษา 1,110 รายที่ได้รับยาหลอก ซึ่งบ่งชี้ถึงค่าประมาณการจุดยุติด้าน ประสิทธิผล เป็นร้อยละ 100 (ช่วงความเชื่อมั่น 95% เท่ากับ 78.1 และ 100.0) เช่นกัน
ในการศึกษาที่ 2 มีการวิเคราะห์ระดับ SARS-CoV-2neutralising titres ที่ 1 เดือนหลังจากที่ได้รับวัคซีนเข็ม ที่ 2 ซึ่งเป็นการวิเคราะห์ข้อมูลในกลุ่มย่อยของผู้เข้าร่วมการศึกษาที่ถูกสุ่มเลือกโดยเป็นผู้ที่ไม่มีหลักฐานทาง ภูมิคุ้มกันวิทยาหรือทางไวรัสวิทยาของการติดเชื้อ SARS-CoV-2ตั้งแต่อดีตจนถึง 1 เดือนหลังจากที่ได้รับวัคซีน เข็มที่ 2 โดยการเปรียบเทียบนี้ เป็นการเปรียบเทียบการตอบสนองระหว่างผู้ที่มีอายุ 12 ถึง 15 ปี (จำนวน = 190 ราย) กับผู้เข้าร่วมการศึกษาที่มีอายุ 16 ถึง 25 ปี (จำนวน = 170 ราย)
อัตราส่วนค่าไตเตอร์เฉลี่ยเรขาคณิต [geometric mean titres [GMT]] ในกลุ่มที่มีอายุ 12 ถึง 15 ปีต่อกลุ่มที่ มีอายุ 16 ถึง 25 ปีเท่ากับ 1.76 โดยมีช่วงความเชื่อมั่นที่ 95% แบบสองด้าน (2-sided 95% CI) อยู่ที่ 1.47 ถึง 2.10 ซึ่งเป็นไปตามเกณฑ์ความไม่ด้อยกว่า (non-inferiority) ที่ 1.5 เท่า โดยพิจารณาจากขอบล่างของ 2- sided 95% CI ของอัตราส่วนค่าเฉลี่ยเรขาคณิต [geometric mean ratio [GMR]] ที่มากกว่า 0.67
5.2. คุณสมบัติทางเภสัชจลนศาสตร์
ไม่เกี่ยวข้อง
5.3. ข้อมูลความปลอดภัยจากการศึกษาพรีคลินิก
ข้อมูลที่ไม่ใช่การศึกษาทางคลินิกเผยให้เห็นว่าไม่มีอันตรายเป็นพิเศษต่อมนุษย์จากการศึกษาแบบมาตรฐาน ด้านความเป็นพิษในการให้ยาซ้ำ ๆ และความเป็นพิษต่อระบบสืบพันธุ์และพัฒนาการ
ความเป็นพิษทั่วไป
การฉีดโคเมอร์เนตีเข้ากล้ามเนื้อในหนู (rat) (ได้รับวัคซีนในขนาดยาเต็ม 3 โดสของที่ให้ในมนุษย์ สัปดาห์ละครั้ง ซึ่งทำให้มีระดับยาเชิงสัมพัทธ์ในหนูที่สูงกว่าเนื่องมาจากความแตกต่างของน้ำหนักตัว) ได้แสดงให้เห็นถึงอาการ บวมบริเวณที่ฉีดยาและผิวหนังแดง และมีเซลล์เม็ดเลือดขาวเพิ่มขึ้น (รวมถึงเม็ดเลือดขาว basophil และเม็ด เลือดขาว eosinophil) ซึ่งสอดคล้องกับการตอบสนองต่อการอักเสบ ตลอดจนการเกิดช่องว่างของ portal hepatocytes โดยไม่มีหลักฐานของการบาดเจ็บที่ตับ ผลทั้งหมดสามารถหายกลับเป็นปกติได้
พิษทางพันธุกรรม/ฤทธิ์ก่อมะเร็ง
ไม่ได้ทำการศึกษาพิษทางพันธุกรรมหรือฤทธิ์ก่อมะเร็ง ไม่คาดว่าส่วนประกอบของวัคซีน (ไขมันและ mRNA) จะมีความเป็นไปได้ที่จะก่อให้เกิดพิษทางพันธุกรรม
ความเป็นพิษต่อระบบสืบพันธุ์
ได้ทำการศึกษาความเป็นพิษต่อระบบสืบพันธุ์และความเป็นพิษต่อพัฒนาการในหนู (rat) ในการศึกษาร่วมกัน ทางด้านความเป็นพิษต่อระบบสืบพันธุ์และความเป็นพิษต่อพัฒนาการ โดยฉีดโคเมอร์เนตีเข้ากล้ามเนื้อในหนู เพศเมียก่อนช่วงผสมพันธุ์และในระหว่างตั้งครรภ์ (ได้รับวัคซีนในขนาดยาเต็ม 4 โดสของที่ให้ในมนุษย์ซึ่งทำให้ มีระดับยาเชิงสัมพัทธ์ในหนูที่สูงกว่าเนื่องมาจากความแตกต่างของน้ำหนักตัว โดยฉีดวัคซีนระหว่างช่วงก่อนการ ผสมพันธุ์วันที่ 21 และช่วงตั้งครรภ์วันที่ 20) พบว่ามีการตอบสนองของแอนติบอดีหักล้างฤทธิ์ต่อ SARS-CoV-2 (neutralising antibody) ในสัตว์ตัวแม่จากระยะก่อนการผสมพันธุ์ไปจนถึงจุดสิ้นสุดการศึกษา ซึ่งเป็นวันที่ 21 หลังคลอด ทั้งยังพบการตอบสนองในตัวอ่อนในครรภ์และในลูกสัตว์อีกด้วย ไม่มีผลที่เกี่ยวข้องกับวัคซีนต่อการ สืบพันธุ์ของตัวเมีย การตั้งครรภ์ หรือพัฒนาการของเอ็มบริโอ-ตัวอ่อนในครรภ์ หรือลูกสัตว์ ไม่มีข้อมูลของ โคเมอร์เนตีเกี่ยวกับการข้ามผ่านรกของวัคซีนหรือการขับวัคซีนออกทางน้ำนม
6. รายละเอียดทางเภสัชกรรม
6.1. รายการตัวยาไม่สำคัญ ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) (ALC-0315) 2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide (ALC-0159) 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC) Cholesterol Potassium chloride Potassium dihydrogen phosphate Sodium chloride Disodium phosphate dihydrate Sucrose Water for injections
6.2. ความไม่เข้ากันของยา
ห้ามผสมผลิตภัณฑ์ยานี้กับผลิตภัณฑ์ยาชนิดอื่น ๆ ยกเว้นผลิตภัณฑ์ยาที่ได้ระบุไว้ในหัวข้อ 6.6. ข้อควรระวัง พิเศษในการกำจัดและการบริหารจัดการอื่น ๆ 14
6.3. อายุของยา
ขวดวัคซีนที่ยังไม่ได้เปิดใช้
ขวดวัคซีนที่แช่แข็ง
6 เดือนที่อุณหภูมิ -90 องศาเซลเซียสถึง -60 องศาเซลเซียส ภายในช่วงอายุการใช้งาน 6 เดือน สามารถเก็บและขนส่งวัคซีนในขวดที่ยังไม่ได้เปิดใช้ที่อุณหภูมิ -25 องศา เซลเซียสถึง -15 องศาเซลเซียส ได้เพียงครั้งเดียวและต้องไม่เกิน 2 สัปดาห์และสามารถนำกลับไปเก็บแช่แข็ง ที่อุณหภูมิ -90 องศาเซลเซียสถึง -60 องศาเซลเซียส ได้
ขวดวัคซีนที่ละลายจากการแช่แข็งแล้ว
1 เดือน ที่ 2 องศาเซลเซียสถึง 8 องศาเซลเซียส ภายในช่วงอายุการใช้งาน 1 เดือน ที่อุณหภูมิ 2 องศาเซลเซียสถึง 8 องศาเซลเซียสนี้ อาจทำการขนส่งได้ แต่ ต้องใช้ระยะเวลาไม่เกิน 12 ชั่วโมง ก่อนใช้งาน สามารถเก็บขวดวัคซีนที่ยังไม่ได้เปิดใช้ได้นาน 2 ชั่วโมง ที่อุณหภูมิสูงถึง 30 องศาเซลเซียส
เมื่อวัคซีนละลายจากการแช่แข็งแล้ว ต้องไม่นำกลับไปแช่แข็งซ้ำ
การจัดการกับอุณหภูมิ นอกเหนือจากที่ระบุในสภาวะจัดเก็บเมื่อนำวัคซีนออกจากตู้แช่แข็ง
ข้อมูลความคงตัวบ่งชี้ว่าวัคซีนในขวดวัคซีนที่ยังไม่ได้เปิดใช้มีความคงตัวนาน ดังนี้
• 24 ชั่วโมงเมื่อเก็บที่อุณหภูมิจาก -3 องศาเซลเซียสถึง 2 องศาเซลเซียส
• รวม 4 ชั่วโมงเมื่อเก็บที่อุณหภูมิ 8 องศาเซลเซียสถึง 30 องศาเซลเซียส ซึ่งรวมถึงระยะเวลา 2 ชั่วโมงที่อุณหภูมิสูงถึง 30 องศาเซลเซียสดังที่ได้แสดงรายละเอียดไว้ด้านบน
ข้อมูลนี้มีวัตถุประสงค์ให้เป็นแนวทางสำหรับบุคลากรทางการแพทย์เท่านั้นในกรณีที่อุณหภูมิออกนอกช่วงที่ ระบุในสภาวะจัดเก็บชั่วคราว
การขนส่งขวดวัคซีนที่ถูกแช่แข็งซึ่งเก็บไว้ที่อุณหภูมิต่ำเป็นพิเศษ (ต่ำกว่า -60 องศาเซลเซียส)
• ถาดบรรจุขวดวัคซีนชนิดมีฝาปิด มีขวดวัคซีนบรรจุอยู่ 195 ขวดซึ่งถูกนำออกมาจากตู้แช่แข็งที่มีอุณหภูมิ ต่ำเป็นพิเศษ (ต่ำกว่า -60 องศาเซลเซียส) สามารถเก็บไว้ที่อุณหภูมิสูงถึง 25 องศาเซลเซียสได้นานถึง 5 นาที
• ถาดบรรจุขวดวัคซีนชนิดฝาเปิด หรือถาดบรรจุขวดวัคซีนที่มีขวดวัคซีนบรรจุอยู่น้อยกว่า 195 ขวดซึ่งถูก นำออกมาจากตู้แช่แข็งที่มีอุณหภูมิต่ำเป็นพิเศษ (ต่ำกว่า -60 องศาเซลเซียส) สามารถเก็บไว้ที่อุณหภูมิสูง ถึง 25 องศาเซลเซียสได้นานถึง 3 นาที
• หลังจากที่นำถาดบรรจุขวดวัคซีนกลับไปเก็บที่ตู้แช่แข็งหลังจากสัมผัสอุณหภูมิสูงถึง 25 องศาเซลเซียส จะต้องเก็บถาดบรรจุขวดวัคซีนไว้ในตู้แช่แข็งอย่างต่อเนื่องเป็นเวลาอย่างน้อย 2 ชั่วโมงก่อนที่จะนำออกมา จากตู้แช่แข็งอีกครั้ง 15
การขนส่งขวดวัคซีนที่ถูกแช่แข็งซึ่งเก็บไว้ที่อุณหภูมิ-25 องศาเซลเซียสถึง -15 องศาเซลเซียส
• ถาดบรรจุขวดวัคซีนชนิดมีฝาปิด มีขวดวัคซีนบรรจุอยู่ 195 ขวดซึ่งถูกนำออกมาจากตู้แช่แข็ง (-25 องศา เซลเซียสถึง -15 องศาเซลเซียส) สามารถเก็บไว้ที่อุณหภูมิสูงถึง 25 องศาเซลเซียสได้นานถึง 3 นาที
• ถาดบรรจุขวดวัคซีนชนิดฝาเปิด หรือถาดบรรจุขวดวัคซีนที่มีขวดวัคซีนบรรจุอยู่น้อยกว่า 195 ขวดซึ่งถูก นำออกมาจากตู้แช่แข็ง (-25 องศาเซลเซียสถึง -15 องศาเซลเซียส) สามารถเก็บไว้ที่อุณหภูมิสูงถึง 25 องศาเซลเซียสได้นานถึง 1 นาที
เมื่อนำขวดวัคซีนออกมาจากถาดบรรจุขวดวัคซีนแล้ว ควรปล่อยให้ละลายจากการแช่แข็งสำหรับใช้งาน
ผลิตภัณฑ์ยาที่เจือจางแล้ว
วัคซีนที่เจือจางแล้วมีความคงตัวทางเคมีและทางกายภาพสำหรับในขณะใช้งาน (in-use stability) รวมถึงเวลา ในระหว่างการขนส่ง โดยมีความคงตัวเป็นเวลา 6 ชั่วโมง ที่อุณหภูมิ 2 องศาเซลเซียสถึง 30 องศาเซลเซียส หลังจากที่เจือจางในสารละลายโซเดียมคลอไรด์ 9 มิลลิกรัม/มิลลิลิตร (0.9%) สำหรับฉีด จากมุมมองทางจุล ชีววิทยา (ยกเว้นในกรณีที่วิธีการเจือจางวัคซีนจะป้องกันความเสี่ยงของการปนเปื้อนของจุลินทรีย์)ควรใช้ วัคซีนที่เจือจางแล้วทันที หากไม่ใช้ทันที เวลาและสภาวะในการเก็บในการใช้งานจะถือเป็นความรับผิดชอบของ ผู้ใช้
6.4. ข้อควรระวังพิเศษในการเก็บยา
เก็บไว้ในตู้แช่แข็งที่อุณหภูมิ -90 องศาเซลเซียสถึง -60 องศาเซลเซียส เก็บยาไว้ในบรรจุภัณฑ์เดิมเพื่อไม่ให้ยาโดนแสง ในระหว่างการเก็บรักษา ให้ขวดวัคซีนสัมผัสแสงไฟในห้องให้น้อยที่สุด และหลีกเลี่ยงการโดนแสงแดดและแสง อัลตราไวโอเลตโดยตรง
สามารถบริหารจัดการขวดวัคซีนที่ละลายจากการแช่แข็งแล้วในห้องที่มีแสงสว่าง
สำหรับสภาวะการเก็บยาหลังจากที่ละลายจากการแช่แข็งและเจือจางผลิตภัณฑ์ยาแล้ว ดูหัวข้อ 6.3. อายุของยา
6.5. ลักษณะและส่วนประกอบของภาชนะบรรจุ
ขวดแก้วใสความจุขนาด 2 มิลลิลิตรสำหรับใช้หลายครั้ง (multidose vial) (แก้ว type I) ที่มีจุกยาง (ยางโบร โมบิลทิลสังเคราะห์) และฝาปิดพลาสติกแบบ flip-off ที่มีผนึกอลูมิเนียม แต่ละขวดมีวัคซีนบรรจุอยู่ 6 โดส ดู หัวข้อ 6.6. ข้อควรระวังพิเศษในการกำจัดและการบริหารจัดการอื่น ๆ ขนาดบรรจุภัณฑ์: 195 ขวด
6.6. ข้อควรระวังพิเศษในการกำจัดและการบริหารจัดการอื่น ๆ
คำแนะนำในการจัดการ
บุคลากรทางการแพทย์ควรเตรียมโคเมอร์เนตีโดยใช้เทคนิคปราศจากเชื้อเพื่อให้มั่นใจถึงการปลอดเชื้อของ วัคซีนชนิดกระจายตัวที่เตรียม








